Chemie: Redoxgleichungen – Lernposter zum kostenlosen Download
Das kostenlose Lernposter zu Redoxgleichungen samt Definition, Beispielen und Lösungsweg können Sie hier downloaden und ausdrucken.
Das Lernposter wurde von unseren Chemie-Experten bei sofatutor.com erstellt. Sie können es entweder über das Download-Tool kostenlos herunterladen oder das Bild bzw. PDF abspeichern und ausdrucken.
Download
Lernposter_Chemie_Redoxgleichungen.pdf (Dateigröße: 1MB)
Um den Download zu starten, geben Sie Ihre E-Mail-Adresse ein. Klicken Sie anschließend auf „Jetzt herunterladen“.
Danke! Der Download wurde automatisch gestartet.
Videos und Übungen zu den Redoxgleichungen finden Sie auf der Themen-Seite von sofatutor.com.
Beispiele für Redoxreaktionen sind:
- Feuer
- Thermit schweißen
- Rost
- Metallgewinnung
- Anlaufen von Münzen
- Batterien
Definitionen
1. Oxidation
vereinfacht eine Reaktion eines Stoffes mit Sauerstoff, wobei ein Oxid entsteht.
erweitert eine Reaktion, bei der Elektronen abgegeben werden. Die Oxidationszahl erhöht sich.
2. Reduktion
vereinfacht eine Reaktion, bei der Sauerstoff aus einer Verbindung abgegeben wird.
erweitert eine Reaktion, bei der Elektronen aufgenommen werden. Die Oxidationszahl verringert sich.
3. Redoxreaktion
Oxidation und Reduktion laufen niemals unabhängig voneinander ab. Sie sind immer aneinander gekoppelt.
Damit wird jede Redoxreaktion zu einer Elektronenübertragungsreaktion, bei der Elektronen vom Oxidationsmittel aufgenommen und zum Reduktionsmittel abgegeben werden.
Oxidationszahlen
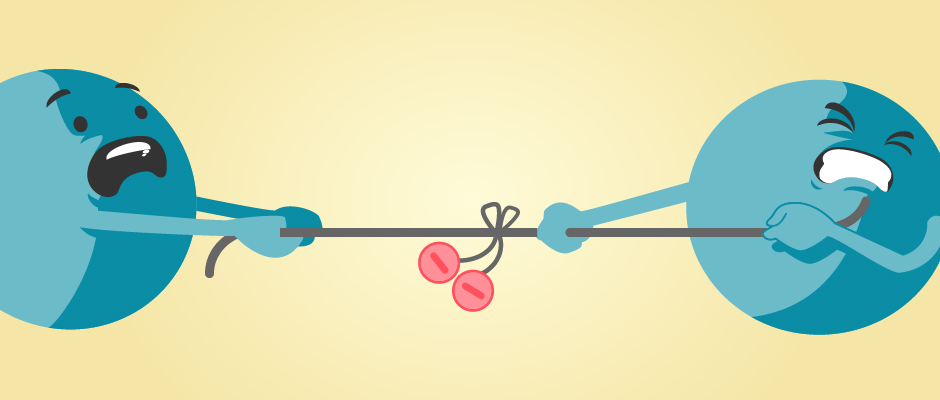
Stell dir vor, die Bindungselektronen liegen auf einem Seil zwischen den Atomen.
Wenn beide Atome nun an dem Seil ziehen, zieht das elektronegativere Element die Elektronen zu sich.
Definition Oxidationszahl
Die Oxidationszahl ist eine formale Ladung. Sie entsteht, wenn man sich das Molekül aus Ionen aufgebaut vorstellt und entspricht dann der Ionenladung, die entsteht, wenn die Bindungselektronen dem
elektronegativeren Partner zugeordnet werden.
Oxidationszahl H: + I
Oxidationszahl O: – II
Regeln für Oxidationszahlen
- Die Oxidationsstufe eines reinen Elementes ist immer Null.
- Bei einfachen Ionen entspricht die Oxidationszahl der Ladung.
- In Molekülen ist die Summe der Oxidationszahlen immer Null.
- Die Summe der Oxidationszahlen in einem komplexen Ion entspricht der Ladung des Ions.
Lösen von Redoxgleichungen
- Wortgleichung aufstellen
- Oxidationszahlen bestimmen
- Oxidation und Reduktion aufschreiben
- Elektronen ausgleichen
- Gleichungen zusammenfassen und Elektronen rauskürzen
- Sauerstoff ausgleichen
Weitere Lernposter
Titelbild: © sofatutor.com
Weitere Verwandte Artikel
Kommentieren







Eure Lernposter allgemein und fürs Abi sind wirklich hilfreich.
Schön wäre es noch, wenn sie ein besseres Format zum Ausdrucken hätten. Bei diesem Format ist ein Ausdruck in DinA4 tlw. nur schwer zu lesen
Danke wunderbar